Bulletin N°20

Le traçage de lignage cellulaire via Spp1 révèle la plasticité liée à l'âge des cellules microgliales après lésion cérébrale - Immunity- Février 2024
Les cellules microgliales non-homéostatiques qui se développent au cours de situations pathologiques sont désignées par l’acronyme DAM (« disease associated microglia »). Dans ce cadre général, la plasticité des DAM en réponse à chaque situation pathologique reste largement inconnue. Dans cette étude, les auteurs ont établi chez la souris un système de traçage des DAM qui exploite la dynamique d'expression du gène Spp1 codant pour l’ostéopontine. Le traçage cellulaire (« fate mapping ») des DAM Spp1+ a été réalisée dans un modèle d’accident vasculaire cérébral chez des souris nouveau-nées et chez des souris juvéniles. Chez les souris nouveau-nées, les DAM présentent une plasticité élevée et retrouvent une signature homéostatique après récupération. Néanmoins, les DAM ayant réintégré le réseau microglial homéostatique conservent une mémoire immunitaire des événements néonataux, ce qui les rend plus sensibles à des stimuli immunitaires ultérieurs. Par opposition, chez les souris juvéniles, les cellules microgliales DAM tendent à conserver leur phénotype jusqu’à la phase de récupération et sont finalement éliminées du cerveau.
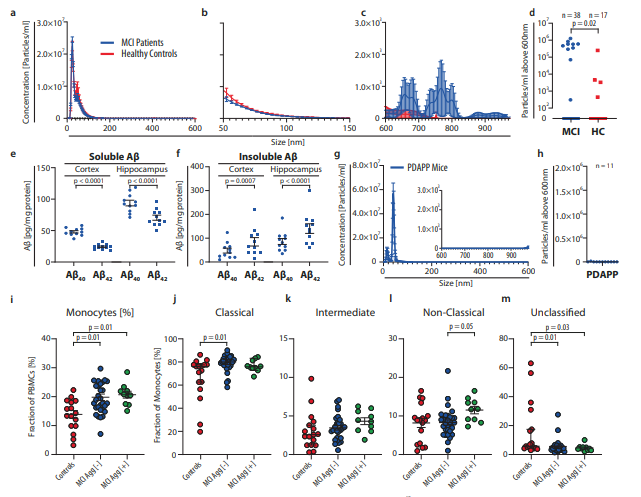
Les agrégats d'Amyloide-β activent les monocytes périphériques dans le cadre du déficit cognitif léger - Nature Communications - Février 2024
La maladie d'Alzheimer est communément précédée d’une période prodromique au cours de laquelle un déficit cognitif léger (MCI pour « mild cognitive impairment ») est observé. Dans cette étude, les auteurs rapportent la présence de larges agrégats d'amyloide beta (Aβ) dans le plasma de patients atteints de déficit cognitif léger. La présence de ces agrégats sanguins est associée à une pathologie cérébrale de type maladie d'Alzheimer à un temps précoce, observable par imagerie TEP (tomographie par émission de positons) en utilisant le ligand d’amyloïde 11C-PiB et le ligand de Tau 18F-FTP. On observe également une diminution du pourcentage de monocytes circulants exprimant CD18. Les auteurs démontrent que le récepteur au complément de type 4 (CR4), formé de l’hétérodimère CD11C/CD18, se lie aux agrégats d’amyloïde et promeut leur phagocytose. Les auteurs émettent l’hypothèse que CD18 favorise la transmigration des monocytes vers les zones corticales riches en agrégats d’Aβ.

L’analyse intégrée de la transcriptomique spatiale et sur cellules uniques permet de caractériser l'architecture moléculaire et cellulaire du cerveau en situation d’ischémie - Science Translational Medicine – Février 2024
Dans cette étude, nous avons utilisé la transcriptomique spatiale et l’analyse RNA-seq sur cellule unique (« single-cell RNA-seq ») pour étudier différentes zones du cerveau de souris dans un modèle expérimental d’accident vasculaire cérébral (AVC). Cette approche a notamment permis de réaliser une annotation spatiale des gènes différentiellement exprimés dans la zone péri-infarctus. L'analyse des interactions ligand-récepteur a révélé que la galectine-9 avec la glycoprotéine membranaire Cd44 (Lgals9-Cd44) constituait une voie de signalisation critique après une lésion ischémique. Les cellules microgliales et les macrophages ont été identifiés comme la principale source de galectines après un AVC. L’administration de Lgals9 via des vésicules extracellulaires a permis d'améliorer la récupération fonctionnelle à long terme chez les souris atteintes d'un AVC. Le knockdown de Cd44 a partiellement inversé ces effets thérapeutiques, en inhibant la différenciation des oligodendrocytes et la remyélinisation.

Les cellules microgliales sur les sites d'atrophie restreignent la progression de la dégénérescence rétinienne via la galectine-3 et Trem2 - Journal of Experimental Medicine – Janvier 2024
La dégénérescence maculaire liée à l'âge (DMLA), se caractérise par l'atrophie des photorécepteurs et de l'épithélium pigmentaire rétinien (EPR). Des cellules phagocytaires (macrophages, microglie) s'accumulent dans ces sites de tissu atrophique, mais leur ontogénie et leurs fonctions restent peu connues, notamment chez l’humain. Les auteurs de cette étude identifient dans les cellules microgliales un profil transcriptomique spécifique, caractérisé par une surexpression de la galectine-3 au sein des sites atrophiques, que ce soit dans les modèles murins de dégénérescence rétinienne ou chez les patients atteints de DMLA. Dans les modèles murins de dégénérescence rétinienne, le KO conditionnel de la galectine-3 au niveau des cellules microgliales conduit à un déficit de leurs fonctions phagocytaires et à une augmentation conséquente de la mort des photorécepteurs, des dommages de l'EPR et de la perte de vision. Au plan mécanistique, la signalisation via Trem2 orchestre la migration des cellules microgliales vers les sites atrophiques et induit l'expression de galectine-3. Ainsi, l’administration d’un agoniste pharmacologique de Trem2 confère une protection accrue via les cellules microgliales et de manière dépendante de la galectine-3. Par ailleurs, chez les sujets humains âgés, les auteurs identifient également une population microgliale exprimant la galectine-3 et Trem2. Cette population est significativement enrichie au niveau de l'EPR et de la choroïde dans la macula des sujets atteints de DMLA.

L’activité cytotoxique indépendante de l'antigène exercée par les lymphocytes T CD8 est responsables des signes neuropathologiques induits par le virus Zika – Nature Communications - Février 2024
Les auteurs de cette étude montrent que dans un modèle murin d'infection par le virus Zika (ZIKV), la gravité des signes neurologiques n’est pas corrélée avec les titres de ZIKV dans le cerveau, mais plutôt avec l'infiltration intracérébrale de lymphocytes T CD8+ non spécifique (« bystander ») exprimant NKG2D. Le blocage de NKG2D ou la déplétion des lymphocytes T CD8 préviennent les signes neurologiques induit par ZIKV. Les auteurs montrent également que les lymphocytes T CD8+ de la rate et du cerveau présentent une cytotoxicité indépendante de l'antigène et qui est corrélée à l'expression de NKG2D. Ces résultats suggèrent que lors d’une infection par ZIKV, les lymphocytes T CD8+ induisent une maladie neurologique de façon indépendant de l’antigène et de la signalisation de récepteur des lymphocytes T (TCR = T cell receptor).

Une fréquence très élevée de lymphocytes B matures et réactifs aux autoantigènes LGI1 ou CASPR2 caractérise le liquide céphalorachidien de patients atteints d'encéphalite auto-immune - PNAS- Février 2024
La synthèse intrathécale d'autoanticorps reconnaissant des antigènes du système nerveux central (SNC) est observée chez les patients atteints d'encéphalite auto-immune (EA). Les auteurs de cette étude ont réalisé un profilage moléculaire exhaustif des récepteurs B (BCR) à partir de prélèvement de liquide céphalo-rachidien (LCR) issus de patients atteints d'EA. À partir du LCR de trois patients EA présentant des autoanticorps anti-LGI1 ou anti-CASPR2 , 381 paires cohérentes de BCR et d’IgG ont été isolées par tri cellulaire et RNA-seq sur cellule unique (« single-cell RNA-seq »). Sur ces 181 BCR séquencés, 166 ont été exprimés sous forme d'anticorps monoclonaux (mAbs). Les auteurs ont observé que 62% des mAbs générés à partir de BCR singletons réagissaient soit avec LGI1, soit avec CASPR2. De manière surprenante, ce chiffre atteignait 100 % des BCR dans des groupes clonaux (familles de BCR) composés d’au moins 4 membres. Cette réactivité aux autoantigènes s’est révélée plus élevée dans les BCR issus de cellules sécrétrices d'anticorps comparé aux lymphocytes B dans leur ensemble (P < 0,0001). Les BCR de cellules réactives aux autoantigènes semblent avoir acquis peu de mutations en intrathécal et présentent peu de variations en termes d’affinité au sein de clones similaires. Dans l'ensemble, chez les patients atteints d'encéphalite à anticorps anti-LGI1 ou anti-CASPR2, ces résultats identifient le LCR comme un compartiment présentant une fréquence remarquablement élevée de clone B synthétisant des autoanticorps. L’expansion de ces clones et leur différenciation terminale semblent être acquise de manière dominante en dehors du SNC.