Bulletin N°56






Les brèves du Bulletin N°56
Article N°1
Les agrégats cellulaires de microglie définissent différentes niches de neurodégénérescence au sein de l’hippocampe chez les patients atteints de maladie d’Alzheimer
Acta Neuropathologica – Février 2025
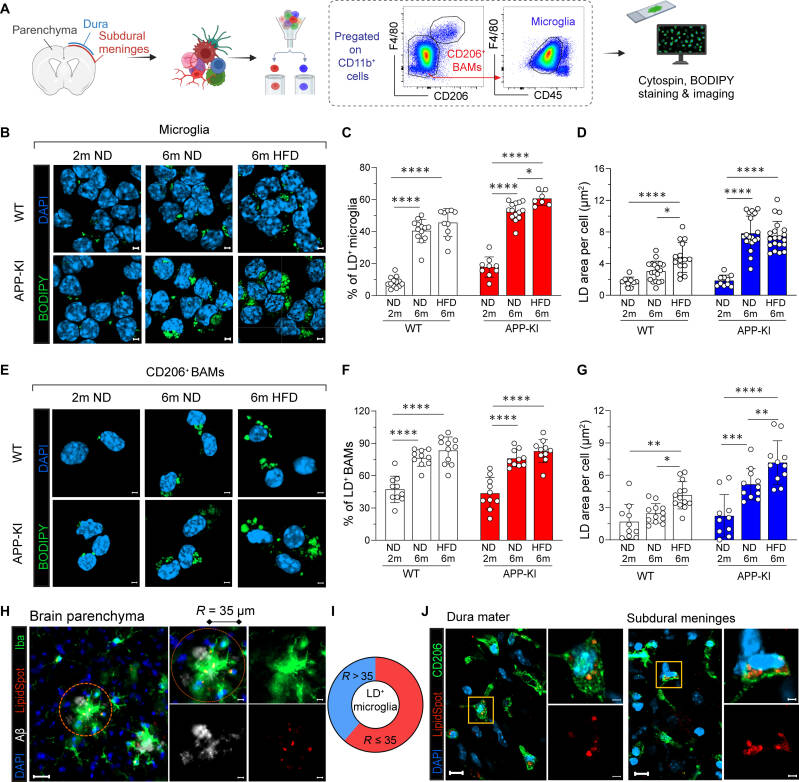
Article N°2
Ifi27l2a est un gène clé régulant l’activation microgliale dans l’AVC et au cours du vieillissement
Nature Communications – Février 2025
Article N°3
DeepCellMap, une approche basée sur le deep learning et les statistiques spatiales, révèle l’organisation spatiale de la microglie dans le cerveau en développement
Nature Communications – Février 2025
Article N°4
Evaluation de la neuroinflammation dans la maladie de Parkinson et les pathologies apparentées
Annals of Neurology – Février 2025
Article N°5
Analyse spatiotemporelle du transcriptome microgliale dans un modèle murin de paludisme : impact du traitement par artémisinine
Nature Communications – Février 2025
Article N°6
L’imagerie par IRM quantitative identifie des signes d’inflammation corticale chez les patients souffrant de migraine
Annals of Neurology – Février 2025
Article N°7
Cartographie moléculaire des antigènes présentés aux lymphocytes T dans le médulloblastome : une étude multiomique
Nature Communications – Février 2025
Article N°8
L’irradiation FLASH sensibilise les cellules de médulloblastome aux traitements par CAR T-cells : implication du métabolisme lipidique et des macrophages infiltrants
Nature Cancer – Février 2025
Article N°9
L’administration d’un adénovirus Oct4-Sox2-Klf4 permet le rajeunissement cellulaire des neurones et leur protection dans un contexte inflammatoire
Cell Reports – Février 2025
Article N°10
Les plaquettes sanguines modulent la mémoire de la peur chez la souris
Cell Reports – Février 2025